Sebbene molti esperti considerano la saturazione al 90% un giusto valore per permettere la sopravvivenza dei tessuti, non ci sono studi che lo dimostrino, inoltre molti pazienti vivono con saturazioni di ossigeno molto più basse. In condizioni particolari, dove vi è maggior richiesta di ossigeno come nella sepsi, nel trauma ecc, questi valori bassi di saturazione possono non bastare.
Negli individui sani i valori di pressione arteriosa di ossigeno variano con l’età seguendo questa tabella:
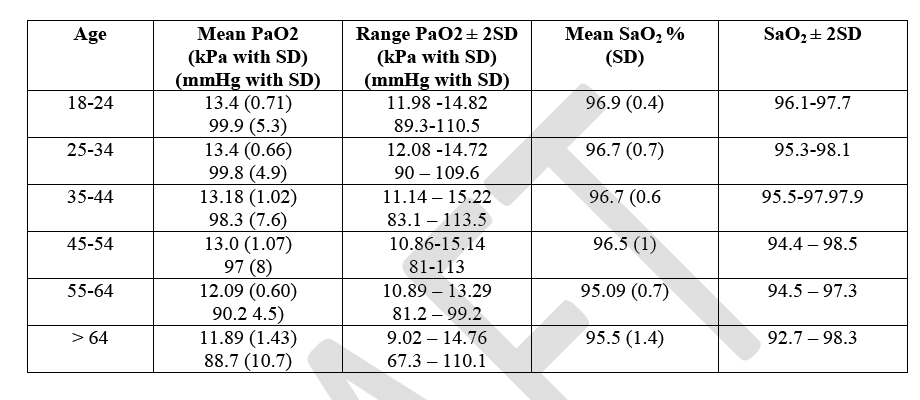
Inoltre esistono tra posizione supina e ortostatica 6 mmHg di differenza . Difficile quindi dare un range di normalità.
La PaCO2 normale è tra 34-45 mmHg e valori oltre i 45 mmHg sono patologici seppur in persone che trattengono a lungo il respiro si può arrivare a 50 mmHg.
La saturazione normale del giovane seduto è 96-98%, si abbassa a 92.5% negli uomini seduti oltre 70 anni, nelle donne > 70 anni sedute se supine scende al 91.5%.
Molti pazienti con BPCO, malattia neuromuscolare, fibrosi polmonare hanno saturazioni molto più basse anche in fasi di stabilità di malattia.
Durante la notte tutti gli individui hanno momenti con saturazione pari al 90%
DEFINIZIONI
IPOSSIEMIA: bassa pressione di ossigeno nel sangue ma non vi è accordo sul valore. La maggior parte parla di valor inferiori a 60 mmHg e 90% di saturazione.
INSUFFICIENZA RESPIRATORIA DI TIPO 1 : l’ipossiemia con normo o ipocapnia.
IPOSSIA: è un termine generico che si riferisce a bassi contenuti di ossigeno nell’organismo. Esistono 4 categorie:
- Ipossia ipossiemica equivale all’ipossiemia
- Ipossia stagnante : scarso circolo arterioso che non riesce a portare ossigeno ai tessuti
- Ipossia anemica . scarsa quantità di emoglobina per trasportare ossigeno ai tessuti
- Ipossia istotossica : impossibilità delle cellule di usare ossigeno.
IPEROSSIA E IPEROSSIEMIA: significano alte quantità di ossigeno nell’organismo e altre pressioni di ossigeno nel sangue. Da notare che oltre i 120 mmHg la saturazione è sempre del 100%.
IPERCAPNIA: valori di PaCO2 > 45 mmHg , segno di INSUFFICIENZA RESPIRATORIA DI TIPO 2 anche con ossiemia nei limiti.
ACIDOSI : ph < 7.35
ALCALOSI : ph > 7.45
ACIDOSI RESPIRATORIA: condizione di acidosi dovuta alla elevata PaCO2
ACIDOSI METABOLICA: è dovuta a una perdita di bicarbonato o a una produzione esagerata di acidi come nella acidosi lattica da ipossia o nella chetoacidosi. Per compenso la PaCO2 è ridotta.
FISIOLOGIA DEI GAS NEL SANGUE
LIVELLO BASE
L’ossigeno penetra attraverso l’apparato respiratorio e in parte si lega all’emoglobina e in parte è disciolto nel plasma La parte legata si calcola con il saturimetro che ci dice quanta emoglobina in percentuale ha legato ossigeno mentre la parte disciolta si misura con la PaO2. Un paziente può avere scarso apporto di ossigeno sia per motivi polmonari che per motivi legati all’emoglobina ( anemia, intossicazione da monossido di carbonio).
La saturazione normale nel giovane è 94-98%, nell’anziano > 70 anni 92-98% , una saturazione < 78% crea in qualunque paziente gravi danni d’organo; nei pazienti critici il bisogno di ossigeno è incrementato.
Se vi è un problema parenchimale polmonare che impedisce il passaggio di ossigeno si ha una vasocostrizione dei capillari polmonari e i globuli rossi vengono deviati verso aree meglio ventilate.
L’attività respiratoria è modulata dal livello di ossigeno grazie a dei sensori carotidei che incrementano la ventilazione se il contenuto di ossigeno si riduce.
L’anidride carbonica ( CO2 ) è prodotta dai tessuti, trasportata negli alveoli polmonari ed espulsa con l’espirio. Il trasporto avviene tramite bicarbonato, una parte disciolta e una parte legata all’emoglobina. Visto che la parte legata dipende dalla pressione parziale di CO2, questo valore è un indice di quantità di CO2; il valore normale è 34-45 mmHg.
L’eliminazione di CO2 è importante con l’assunzione di O2. Una alta CO2 porta allo stimolo dell’attività respiratoria e alla sua eliminazione. Poco ossigeno è pericoloso ma pure troppo ossigeno è deleterio in pazienti con BPCO, neuropatie , deformità toraciche. Un quarto di questi pazienti, se assumono troppo ossigeno incrementano pure la ritenzione di CO2 e possono entrare in coma.
Si potrebbe pensare di dare al paziente critico tanto ossigeno quanto necessario per avere una saturazione del 100%, escludendo i pazienti a rischio di ipercapnia; ma anche l’iperossia ha delle controindicazioni in quanto provoca coronaro e cerebro costrizione riducendo la gittata cardiaca. Tali effetti collaterali non sono però mai stati testati da trials. Alti livelli di ossigeno aumentano i radicali liberi con danno d’organo e creano rapido assorbimento di gas polmonare con formazione di aree di atelettasia. Inoltre una alta quantità di ossigeno aumenta la saturazione ma questo può dare una falsa sicurezza al medico in quanto nulla si sa sulla CO2. Un rapido aumento della CO2 non porta a compenso renale e quindi ad acidosi respiratoria con aumentato rischio di morte nelle BPCO riacutizzate. Il fine ultimo è aumentare l’ossigenazione tessutale , non la quantità di saturazione, per cui può spesso essere utile migliorare la gittata cardiaca e correggere l’anemia.
Attualmente non ci sono trials che abbiano indagato il giusto livello di ossigeno. La pratica consolidata di dare ossigeno a tutti i pazienti critici non è supportata da trials, escluso l’intossicazione da monossido di carbonio.
Tutti gli esperti concordano nel tenere una saturazione di 94-98% per pazienti < 70 anni e 92-98% per i pazienti oltre i 70 anni e con patologie gravi esclusi i BPCO.
LIVELLO AVANZATO
L’asse neuro-cardio-polmonare è deputato al controllo dell’ossigeno e della CO2 ematica.
L’ossigeno trasportato ( DO2) è dato dall’equazione
DO2 = CaO2 x Q con CaO2 = contenuto di O2 ematico
Q = gittata cardiaca
La CaO2 dipende dalla quota disciolta e dalla quota legata all’emoglobina che è predominante.
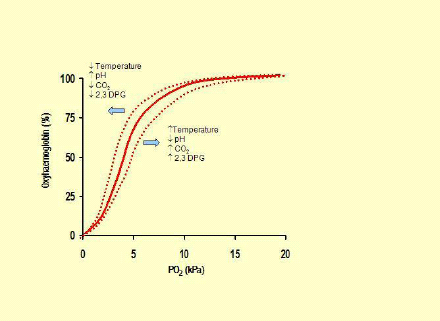
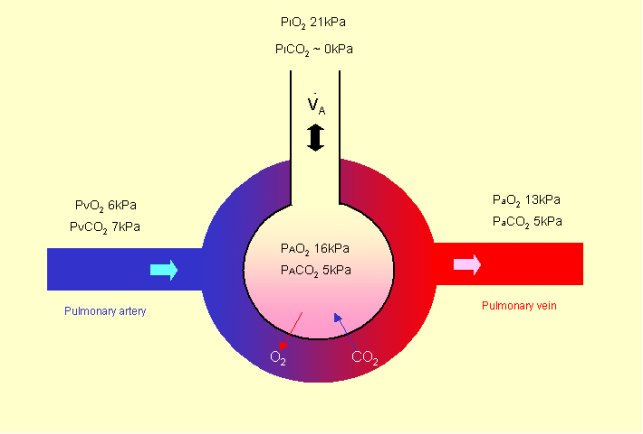
La relazione tra PaO2 e saturazione è data da questa figura
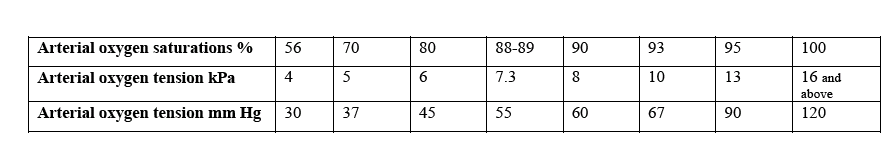
La figura successiva mostra i valori di PaCo2 e PaO2 a livello venoso, arterioso e alveolare polmonare.
NB 1 KPa = 7.6 mmHg
Quando i globuli rossi raggiungono alveoli mal ventilati non si caricano di ossigeno; per evitare ciò esiste una vasocostrizione arteriosa nelle aree poco ventilate che sposta i globuli rossi da tali zone.
Purtroppo spesso aree mal ventilate vengono ancora perfuse e il sangue mal ossigenato che esce da quelle zone riduce la PaO2 perché non può essere compensato dalle aree ben ventilate in quanto la relazione tra SatO2 e PaO2 non è lineare.
ESEMPIO: Il 50% del flusso polmonare passa attraverso un’area ben ventilata uscendo con una saturazione del 97%, l’altra metà passa attraverso aree mal ventilate uscendo con una saturazione dell’ 80%. L’unione delle due parti porta a una saturazione del 88,5%. Se io aumento la quantità di ossigeno inspirata la parte ben ventilata raggiunge il 100% , quella mal ventilata arriva all’85% ma la media è del 92.5% in quanto io posso aumentare la quantità di ossigeno ma al massimo arrivo al 100% di saturazione.
Un fenomeno meno studiato é la broncodilatazione ipossica che incrementa la ventilazione nelle aree poco ventilate.
Se la PaO2 decresce i chemocettori carotidei stimolano una aumentata ventilazione per incrementare la PaO2. Questo perché la PaO2 che lascia le aree mal ventilate aumenta .
Ma i sensori carotidei sentono la PaO2 e non il contenuto di ossigeno e la saturazione di ossigeno. Questo fa sì che l’anemia non stimoli l’iperventilazione.
EMATOCRITO: il rene risente, al contrario dei sensori carotidei, del contenuto di ossigeno , per questo bassi valori di saturazione o l’anemia stimola la secrezione di eritropoietina che incrementa l’ematocrito.
L’EFEETTO BOHR: la capacità dell’emoglobina di legare l’ossigeno dipende pure da fattori metabolici. L’acidosi e l’ipercapnia spostano la curva a destra favorendo il passaggio di O2 ai tessuti. Al contrario la bassa PaCO2 che vi è nel polmone a livello alveolare favorisce il legame di ossigeno spostando la curva a sinistra. L’ipossiemia cronica aumenta il 2-3DPG che sposta la curva a sinistro favorendo l’assorbimento di ossigeno.
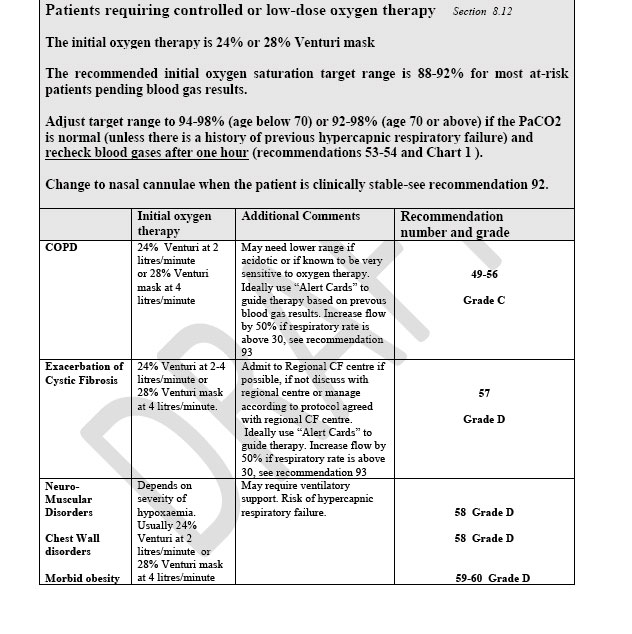
REGOLAZIONE DEL DO2: un basso contenuto di O2 ai tessuti aumenta la contrattilità cardiaca e aumenta la vasodilatazione periferica aumentando il flusso periferico. Il sensore si trova a livello aortico.
FISIOPATOLOGIA DELL’IPOSSIEMIA E DELL’IPEROSSIA
L’ ipossia ipossiemica nel sangue venoso polmonare può essere dovuto a scarsa presenza di O2 a livello alveolare o a un incompleto passaggio di ossigeno dall’alveolo al capillare creando una elevata differenza alveolo-capillare di ossigeno.
PAlvO2 ≈ PIO2 – PAlvCO2 / RQ con PAlvO2 : pressione alveolare di O2
PIO2 : pressione inspiratoria di O2
PAlvCO2: pressione alveolare di CO2
RQ : quoziente respiratorio di CO2
PIO2= FIO2 x (Pressione barometrica { 750 mm Hg} – pressione del vapore acqueo {45 mm Hg} ).
Da queste formule appare chiaro che una bassa PAlvO2 può essere dovuto a una bassa PIO2 e/o una alta PAlvCO2. Ma allora se un area polmonare è poco ventilata rispetto alla perfusione ( V/Q basso) allora la PAlvCO2 si alza e porta a una riduzione della PAlvO2. In condizioni di ipoventilazione globale il rapporto V/P è sempre basso e quindi questo spiega l’ipossia e l’ipercapnia. Una forma estrema di alterazione del rapporto V/Q è parte del parenchima polmonare occluso da un tappo di muco bronchiale e il difetto del setto ventricolare. In entrambi i casi parte di sangue passa in aree non ventilate oppure transita dalla parte destra alla sinistra del cuore senza ossigenarsi.
L’ossigeno a livello capillare polmonare assorbe tutto l’ossigeno necessario in 1/3 di tragitto capillare alveolare. Se vi è difficoltà di diffusione o durante l’esercizio fisico tale tempo si allunga e può crearsi una differenza alveolo-arteriosa di O2 .
L’ipossia anemica può essere dovuta a intossicazione di CO o anemia.
L’iperossia è invece dovuta a iperossiemia o a policitemia. Usando la formula della PAlvO2 l’iperossia può solo esistere se vi è alta PIO2 o bassa PAlvCO2 come nel paziente che iperventila. Il paziente policitemico nella pratica clinica non viene definito iperossico ma tale termine si usa solo per l’iperossiemia.
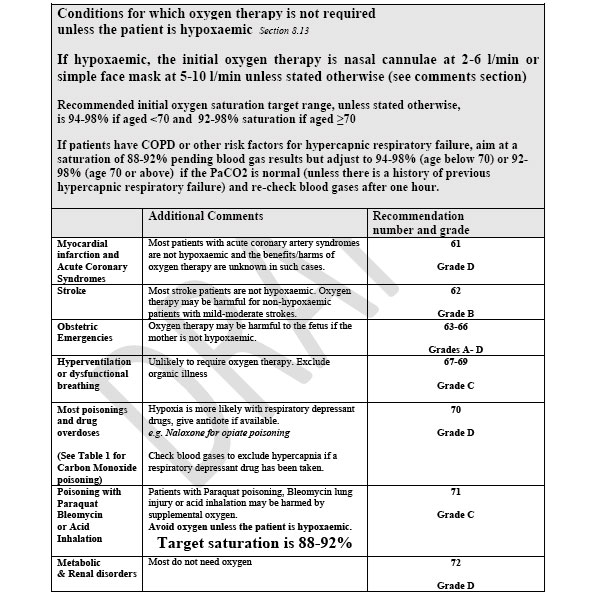
FISIOLOGIA DELLA ANIDRIDE CARBONICA ( CO2 )
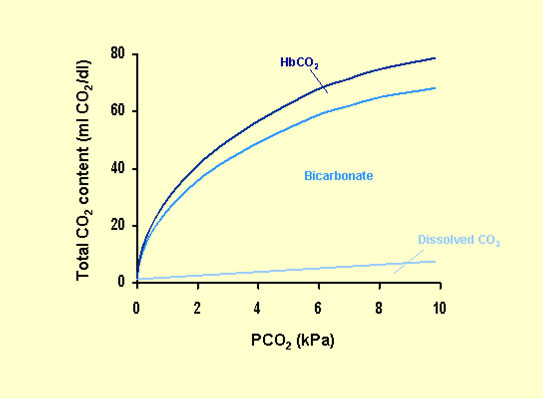
OMEOSTASI DELLA CO2: viene trasportato nel sangue in 3 forme:
- Legata all’emoglobina
- Come bicarbonato
- Disciolta
Nel range fisiologico ( 35-45 mmHg ) la PaCO2 è direttamente proporzionale al contenuto di CO2
REGOLAZIONE DELLA CO2: i sensori sono periferici e centrali ( midollo allungato ) ma agiscono come alterazioni del pH intracellulare: quindi la regolazione della CO2 interferisce con la regolazione del pH.
Quando una area polmonare è poco ventilata ha un alto PAlvCO2, visto che la CO2 è molto diffusibile non si ha mai differenza alveolo arteriosa di CO2 e la PaCO2 in tali pazienti è alta. Ma l’ipercapnia come l’ipossia stimola la vasocostrizione polmonare riducendo al minimo la perfusione in aree non ventilate. La relazione tra PaCO2 e contenuto di CO2 è lineare e non va incontro a saturazione come con la O2 per cui lo stimolo all’iperventilazione della elevata CO2 riduce la PaCO2 delle aree ben ventilate e quindi la PaCO2 si riduce.
Esiste una relazione tra O2 e CO2 nell’emoglobina: una emoglobina desaturata trasporta meglio CO2 : viene detto effetto Haldane.
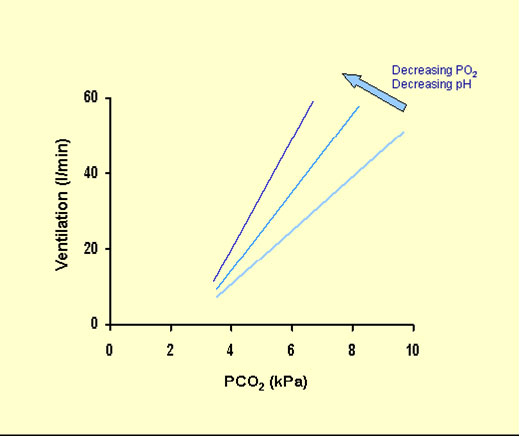
A livello cardiovascolare la CO2 si comporta come un simpaticomimetico; tachicardia, incremento della gittata cardiaca, a livello vascolare crea vasodilatazione.
FISIOPATOLOGIA DELL’IPER E IPOCAPNIA
Ci sono 4 cause di ipercapnia:
- Aumento della CO2 nell’aria inspirata ( rebreathing) ma porta a piccole risalite della CO2 per minuto
- Una aumentata produzione di CO2 tessutale durante fasi di ipercatabolismo ( sepsi, politrauma ecc..)
- Ipoventilazione. Le cause dell’ipercapnia nell’ipoventilazione sono state spiegate. La BPCO è la causa più frequente. Da segnalare che l’iperventilazione nella BPCO riacutizzata porta ad alte frequenze con minimi volumi aumentando il volume dello spazio morto e riducendo i volumi alveolari: sembra quindi giusto parlare di ipoventilazione alveolare.
- Incremento dello spazio morto. Questo in particolare nei pazienti con ventilatori non ben programmati
Altre cause di ipercapnia sono l’alcalosi metabolica e l’esaurimento muscolare di qualunque tipo (distress respiratorio, farmaci, patologie neurologiche).
L’ipocapnia po’ essere dovuta a :
- Ansietà
- In seguito a problemi polmonari con iperventilazione riflessa nel tentativo di mantenere elevata l’ossiemia.
RISCHI ED EFFETTI DELL’IPOSSIEMIA E MINIMA SATURAZIONE DI O2 CONSIGLIATA
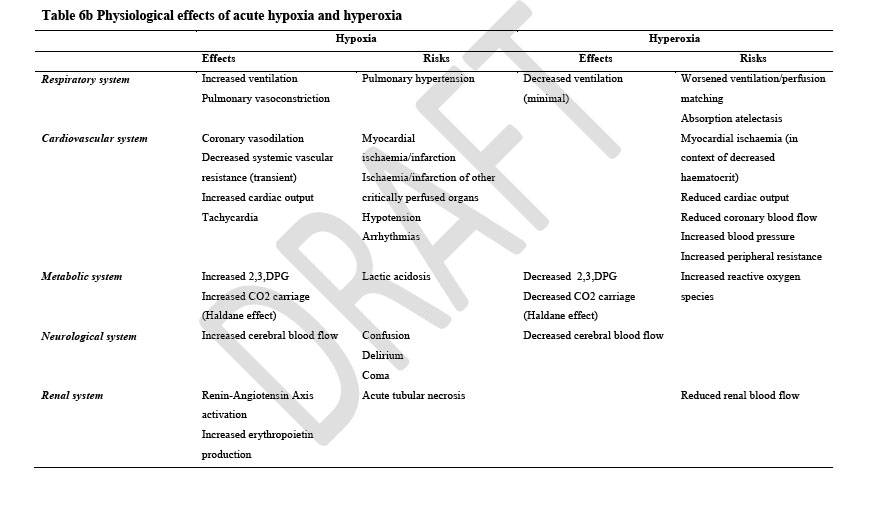
Gli effetti dell’ipossia sono dovuti al basso contenuto tessutale di O2. Ciononostante anche un normale contento di O2 con bassa PaO2 come nella policitemia ha effetti sui sensori carotidei provocando incremento della ventilazione. Non è però dato sapere un valore soglia di PaO2 perché pazienti con BPCO vivono bene con saturazioni dell’80% mentre pazienti politraumatizzato hanno acidosi lattica con saturazione > 90%.
E’ stato descritto che i pazienti con SaO2<90% per lunghi periodi hanno minor sopravvivenza dei pazienti con SaO2>90% ma visto che nel primo gruppo ci sono molti BPCO non è dato sapere quanto nella mortalità è responsabile l’ipossia e quanto la malattia di base.
La funzionalità cerebrale si riduce ad una PaO2<45mmHg ( SatO2 80%) e compare il coma ad una PaO2< 30 mmHg ( SatO2 56% ). I giovani resistono maggiormente all’ipossia in termini di tempo di coscienza e una ipossia graduale è meglio tollerata di una improvvisa.
Uno studio eseguito su pazienti con BPCO durante un volo aereo mostra cadute della saturazione dal 96% a livello del mare all’88-80% durante il volo senza sintomi.
Non essendoci studi randomizzati, questa linea guida giudica l’85% la saturazione minima “sicura” per il paziente. Però il paziente può avere le più svariate patologie per cui si è deciso di considerare il 90% il limite accettabile che diventa il 92% in quanto è previsto nei normali saturimetro un errore del 2%.
Da notare che nei pazienti critico vari sono i parametri da considerare , di cui l’ipossia è solo uno, seppur importante. Un paziente con embolia polmonare massiva rimane grave pure con una saturazione > 92%.
Questa linea guida raccomanda:
- SatO2 94-98% per pazienti < 70 anni
- SatO2 92-98% per pazienti > 70 anni
EFFETTI E RISCHI DELL’IPEROSSIA
Il più importante effetto nocivo è di aumentare l’ipercapnia in pazienti predisposti; questo non avviene in pazienti sani non affetti da patologia polmonare o muscolatoria. Ci sono almeno 5 meccanismi responsabili:
- Durante la ventilazione in aria ambiente aree mal ventilate subiscono vasocostrizione. L’iperossia incrementa il flusso in tali zone mal ventilate e visto che gli alveoli di tali zone sono ricche di CO2 avendo alta PAlvCO2, la PaCO2 si incrementa.
- L’iperossia inibisce i sensori carotidei riducendo la ventilazione. Tale meccanismo sembra però di scarsa importanza.
- L’alta quantità di ossigeno legato all’emoglobina riduce la quantità di CO2 legata ( effetto Haldane)
- Alta PaO2 negli alveoli porta a un grande passaggio di gas nei capillari e conseguenza atelettasia
- L’ossigeno è più viscoso e denso dell’aria e quindi aumenta il lavoro muscolare respiratorio
L’iperossia causa coronaro-costrizione ma non ci sono trials che indagano il problema.
L’iperossia aumenta i radicali liberi ma non ci sono trials che indagano l’impatto in clinica.
L’iperossia, mantenendo alta la saturazione anche in pazienti critici il cui P/F si sta deteriorando, riduce l’attenzione dei sanitari.
L’intossicazione da paraquat e da bleomicina sono potenziate dalla somministrazione di ossigeno. Pure l’aspirazione di acidi nell’albero bronchiale crea maggiori problemi con l’ossigenoterapia.
L’iperossia ha pure alcune indicazioni terapeutiche:
- Intossicazione da CO: l’ emivita della COHb in aria ambiente è di 4 ore, in ossigeno al 100% di 40 minuti.
- Alcuni studi hanno dimostrato il ruolo antiemetico in ambulanza e nel periodo post operatorio
- La chirurgia intestinale ha minori suppurazioni di ferite se il paziente assume 2 ore di ossigeno nel post operatorio.
- Non è dimostrato l’utilità in ulcere diabetiche
- Molte linee guida di CPR consigliano FIO2 del 100% in pazienti in fase di rianimazione. Ha però stupito un RCT su neonati critici in cui la sopravvivenza era maggiore in aria ambiente.
- Svariati studi dimostrano che l’ossigeno migliora la sopravvivenza dei pazienti critici ma non l’iperossia.
RISCHI DELL’IPERCAPNIA ( E ACIDOSI RESPIRATORIA )
Sistema nervoso: crea vasodilatazione e incremento della pressione intracranica, l’acidosi cellulare crea una ipereccitabilità cellulare. Valori sopra i 90-120 mmHg portano a coma.
Sistema endocrino: aumenta il livello di adrenalina e noradrenalina
Circolo polmonare:crea vasocostrizione ma in maniera meno marcata dell’ipossia, creando ipertensione polmonare
Sistema respiratorio: una alta PAlvCO2 riduce la possibilità di risalita della PAlvO2 e quindi peggiora l’ipossia. Inoltre shifta a destra la curva di dissociazione dell’emoglobina.
Sistema cardiovascolare: l’ipercapnia e l’acidosi inibisce la contrattilità miocardica ma lo stimolo delle catecolamine lo compensa creando tachicardia. A livello periferico crea vasodilatazione.
Possibili sono le aritmie.
Sistema renale: l’ipercapnia crea ridotto flusso renale e volume filtrato fino all’anuria.
Elettroliti: vi è un aumento del potassio ematico
SEGNI CINICI:
- Vasodilatazione
- Tremori
- Confusione
- Coma
EFFETTI DELL’ACIDOSI RESPIRATORIA: difficile capire gli effetti dell’acidosi respiratoria visto che contemporaneamente vi sempre ipossia e ipercapnia. E’ certo che una BPCO riacutizzata con pH < 7.3 ha prognosi peggiore.
IL RAZIONALE DELL’OSSIGENOTERAPIA
Si definisce ossigenoterapia il somministrare ossigeno a quantità superiori a quella nell’aria ambiente. Il suo utilizzo è sempre nei pazienti ipossici o intossicati da CO, non esistono indicazioni nel somministrarlo in pazienti dispnoici ma non ipossici.
A livello tessutale l’ossigeno serve ai mitocondri per formare ATP. A livello mitocondriale la PO2 è di 14-22 mmHg. La caduta dall’alveolo ( 159 mmHg ) ai tessuti viene detta caduta dell’ossigeno. Una ridotta PO2 a livello mitocondriale dipende da patologie alveolari, di trasporto, di cessione tessutale. Quindi davanti a una ipossia l’aumento della FI O2 è la prima cosa che si fa ma potrebbe non essere sufficiente.
Purtroppo non è possibile indagare la PO2 mitocondriale per cui è difficile stabilire nel paziente acuto il livello di PaO2 ottimale. Un indice importante ma tardivo è l’acido lattico.
Si sono stabilite delle formule per stabilire la PaO2 ideale che degrada fisiologicamente con l‘età:
PaO2 ideale = 100 mmHg – 0.3 X età che corrisponde a una saturazione del 92-98%
L’ossigenoterapia ha un razionale se la ventilazione è adeguata. In caso di shunt anatomico ha scarse utilità Se l’alveolo è ipoventilato aumentare la FIO2 incrementa la PalvO2 e quindi la PaO2. In caso di ipossia stagnante e anemica aumentare la FIO2 ha scarsi risultati.
STRATEGIE PER AUMENTARE L’OSSIGENAZIONE E IL TRASPORTO
L’ossigenazione tessutale dipende dalla quantità di ossigeno trasportata ( DO2 ) . Questo dipende da vari fattori tra loro sequenziali:
- PaO2: è’ gia stato più volte discusso. Dipende dalla pervietà delle vie aeree, dalla pervietà degli alveoli, da una buona diffusione, da una normale attività muscolare respiratoria, da una terapia broncodilatatrice efficace.
- Emoglobina: per avere un giusto trasporto di O2 occorre un valore adeguato di Hb. Studi non recenti hanno dimostrato che 10 g% è la dose minima per un paziente critico. Studi più recenti hanno dimostrato che 7 g% riduce le complicanze legate alla viscosità ematica nel paziente critico. Un valore comunque certo minimo di Hb non è ancora stato stabilito.
- Ottimizzare il trasporto: una volta ottimizzato la PaO2 e la quantità di emoglobina occorre favorire il ritorno venoso, la contrattilità miocardica e il trasporto ai tessuti. Nei pazienti critici l’ossigeno riduce la mortalità, il rischio operatorio e la degenza in UTI ma nulla si sa dell’iperossia.
EFFETTI DELLA POSIZIONE SUL RAPPORTO V/Q: nel paziente sano esistono dei meccanismi di ridistribuzione per cui il rapporto V/Q è sempre ottimale. Tali meccanismi non sono attivi nel polmone patologico per cui la posizione può influire. La posizione ottimale è quella seduta, che deve essere sempre permessa a meno che non esistano problemi al rachide di natura traumatica. Da ricordare che i pazienti con fibrosi polmonare possono stare meglio seduti, idem per i pazienti con paralisi di un emidiaframma.
VALUTAZIONE CLINICA E LABORATORISTICA NELL’IPOSSIA E IPERCAPNIA
IPOSSIEMIA: il paziente critico deve essere valutato inizialmente applicando l’ ABC e devono essere valutati vari parametri vitali ( vedi Early Warning Scoring system modificato)
tra cui vi è pure la frequenza respiratoria . La saturazione arteriosa di ossigeno nelle prime fasi, grazie all’iperventilazione, può essere nel range di normalità. Attenzione quindi ai minimi cambiamenti di saturazione.

Un Early Warning Scoring systems > 5 è indice di elevata mortalità.
Il colore cianotico della cute in acuto è un elemento mal evidenziabile. Utile invece la saturazione arteriosa di ossigeno. Si è notato che tutti i pazienti ipossici sono tachicardici e tachipnoici, ma quando la saturazione < 70% compare la confusione mentale che può alterare la frequenza cardiaca e respiratoria.
LIMITAZIONI E INDICAZIONI ALL’USO DEL SATURIMETRO: è diventato uno strumento indispensabile come lo sfigmomanometro. Si correla molto bene anche nel paziente critico con la PaO2 , anche quando la satO2 < 80% ( questo nell’ultima generazione di saturimetro ). Ha difficoltà però nel reperire la saturazione nei pazienti ipoperfusi, nei pazienti anemici, con elevata carbossi e metemoglobinemia dove la saturazione è normale ma il trasporto di ossigeno è ridotto. La pelle scura altera i valori sotto l’ 80-85% di saturazione.
PRELIEVO ARTERIOSO E CAPILLARE DEL LOBO AURICOLARE: il prelievo arterioso è sempre il gold standard ma per la PaCO2 e il pH il prelievo capillare dal lobo auricolare ( non dalle dita) ha dato uguali risultati con dolore nettamente ridotto. Per quanto riguarda la PaO2 la differenza va da 3 a 7 mmHg, soprattutto per PaO2 > 65 mmHg. Comunque il primo prelievo deve essere arterioso, i successivi dovrebbero essere capillari dal lobo auricolare, per ridurre il dolore e i rari ma presenti casi di trombosi dell’arteria radiale. In caso di ipotensione i valori capillari lobari auricolari non sono studiati e non sono da eseguire.
VALUTAZIONE DELL’IPERCAPNIA E DELL’ACIDOSI:
E’ spesso accompagnata da distress respiratorio ma in alcuni casi può essere assente, la coscienza tende ad essere depressa oltre una PaCO2 di 90 mmHg, ma ci sono stati casi di sopravvivenza con PaCO2 di 500 mmHg. L’ipercapnia crea vasodilatazione e quindi rossore e cefalea.
Il prelievo arterioso o capillare del lobo auricolare sono equivalenti nella valutazione del pH e della PaCO2. In caso di acidosi respiratoria va ripetuto ogni 30-60 minuti e nel BPCO, se permane acidosi nonostante terapia con O2 a basso flusso , si inizia la NIV. In pazienti a basso rischio di acidosi metabolica, con una buona saturazione di ossigeno, un prelievo venoso può bastare per controllare la PaCO2 e se questa è < 45 mmHg il paziente non è ipercapnico. La misurazione dell’ End Tidal CO2 è utile nella valutazione dell’intubazione e nella valutazione della perfusione nel paziente critico ma non si correla con la PaCO2 nel paziente BPCO. Sono in corso studi su sensori per la determinazione della PaCO2.
USO DELL’OSSIGENO IN EMERGENZA
Tutti i pazienti ipossiemici e quelli a rischio di ipossia, includendo i politraumatizzati, necessitano di ossigeno supplementare. Alcuni pazienti, come i diabetici in chetoacidosi o gli ansiosi, sono tachipnoici ma non beneficiano dall’ossigenoterapia, altri, come gli intossicati da CO , non sono tachipnoici ma beneficiano dell’ossigenoterapia.
A CHI ESEGUIRE L’EMOGASANALISI ( EGA ) ? Tutti i pazienti ipossici necessitano di EGA più rapidamente possibile, ma pure i pazienti con una SatO2 che si riduce rapidamente di 3 punti percentuali necessita di EGA rapidamente. Non è necessaria in pazienti non a rischio di ipercapnia con saturazione
- > 92% in aria ambiente ed età > 70 anni
- > 94% in aria ambiente ed età < 70 anni
a meno che l’EGA serva per valutare l’equilibrio acido-base.
Il saturimetro non dà informazioni sull’equilibrio acido-base e sulla PaCO2 ma è comunque l’unico presidio disponibile in sede pre-ospedaliera.
RACCOMANDAZIONI PER L’ESECUZIONE DELL’EGA:
- ipossiemia inaspettata (< 92% in aria ambiente ed età > 70 anni, < 94% in aria ambiente ed età < 70 anni ) o in pazienti che richiedono ossigeno supplementare per raggiungere il target.
- peggioramento della saturazione o dispnea in pazienti già ipossici
- pazienti stabili che si deteriorano con incremento della FI O2
- pazienti a rischio di ipercapnia che diventano dispnoici, ipossici o manifestano sintomi di ipercapnia
- pazienti con sospette alterazioni dell’equilibrio acido-base
- qualunque altra condizione in cui una EGA può essere utile nel trattamento del paziente, come in un peggioramento dell’ Early Warning Score o un calo della SatO2 di 3 punti percentuali.
QUANTO OSSIGENO SOMMINISTRARE ? : non occorre somministrare ossigeno a FI O2 standard ma quanto necessario per raggiungere la Sat O2 target.
QUAL’E LA SATURAZIONE TARGET DA RAGGIUNGERE?: 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni se non a rischio ipercapnico. Appena possibile eseguire una EGA per valutare la PaCO2: se bassa o normale occorre perseverare nel raggiungimento del target di SatO2, altrimenti in caso di PaCO2 elevata o acidosi respiratoria la SatO2 può essere tenuta a 88-92% iniziando la NIV se disponibile.
QUALE EROGATORE USARE ?: nei politraumatizzati e nei pazienti gravemente ipossici non a rischio di ipercapnia l’uso del reservoir con flusso a 10-15 L è indicato. Successivamente, superato l’episodio acuto, si possono usare sistemi più precisi. Per pazienti modicamente ipossici la canula nasale o la maschera facciale possono bastare a raggiungere la SatO2 target. La maschera di Venturi è utile se necessitano bassi flussi di ossigeno a FIO2 controllata o nei pazienti a rischio di ipercapnia ( 2 L 24% o 4 L 28%)
OSSIGENOTERAPIA RACCOMANDATA NEI PAZIENTI CRITICI
I pazienti critici ipossici necessitano di ossigeno supplementare ad alto flusso con reservoir anche se ipercapnici. Indispensabile una rapida esecuzione di EGA. A questo punto i pazienti ipercapnici saranno indirizzati verso la NIV o l’intubazione orotracheale.
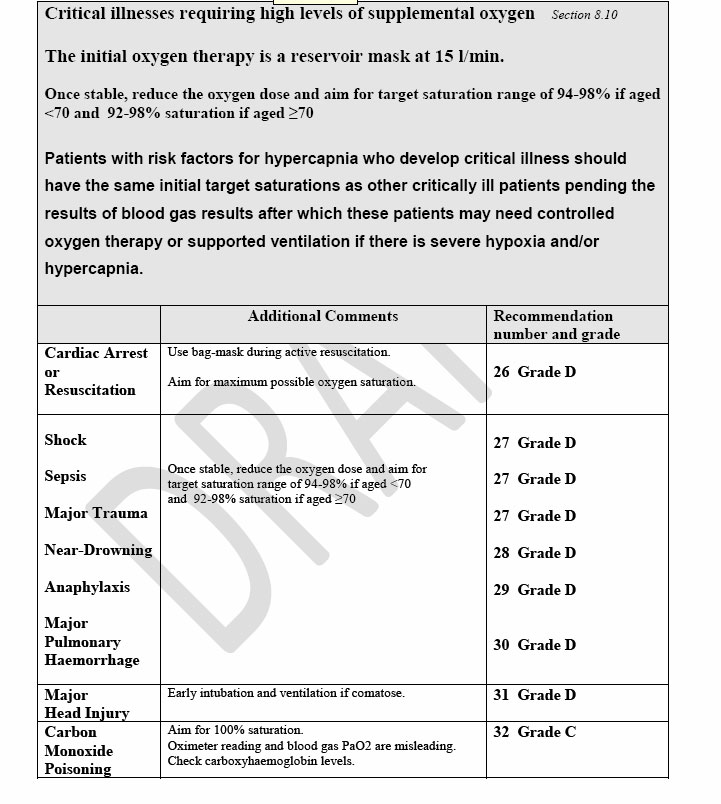
ARRESTO CARDIACO: le linee guida ACLS consigliano ossigeno ad alta FI O2.
SEPSI GRAVE, POLITRAUMA, SHOCK: in tutti questi pazienti si consiglia una saturazione di 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni L’iperossia è sconsigliata perché sembra ridurre il consumo di ossigeno a livello periferico.
POLIFRATTURATI: anche questi pazienti sono a rischio ipossiemico, anche in assenza di problematiche toraciche, per embolie grassose o abuso di oppiacei. Mantenere una saturazione di 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni.
ANNEGATI: mantenere una saturazione > 92%.
ANAFILASSI: i pazienti possono essere ipossici per broncospasmo e ipotensione. Dare ossigeno 10-15 L/minuto
SANGUINAMENTI POLMONARI CON EMOTTISI: possono avvenire per vasculiti o per erosione vascolare da neoplasia polmonare. Oltre al trattamento specifico somministrare ossigeno a 15L / minuto con reservoir per portare la saturazione a 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni.
PATOLOGIA CEREBRALE MAGGIORE: l’ipossia e l’ipercapnia sono frequenti nelle patologie craniche, spesso con necessità di intubazione. L’ipercapnia aumenta i danni cerebrali secondari mentre non c’è evidenza che l’iperossia abbia un ruolo protettivo. Anche qui queste linee guida raccomandano una saturazione di 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni..
INTOSSICAZIONE DA MONOSSIDO DI CARBONIO: l’emivita della CO respirando in aria ambiente è di 300 minuti, in ossigeno al 100% con maschera non rebreathing si riduce a 90 minuti. Quindi fondamentale dare ossigeno a tali pazienti. L’uso della terapia iperbarica è controverso: una review Cochrane del 2005 nega una riduzione di sequele neurologiche con tale terapia ma uno studio randomizzato controllato del 2007 dimostra un miglioramento.
TERAPIA CON OSSIGENO IN PAZIENTI CON PATOLOGIE MEDICHE CHE POSSONO CREARE IPOSSIA
I pazienti con patologie internistiche non a rischio di vita e lievemente ipossici necessitano di ossigenoterapia a bassi flussi con canule nasali. Alcuni di questi pazienti, ad esempio con
polmonite , possono poi deteriorarsi e necessitare di supporti più avanzati, anche invasivi.
Non ci sono dati che l’ossigenoterapia riduca la dispnea in pazienti non ipossici.
PAZIENTI IPOSSICI SENZA DIAGNOSI CERTA: alcuni pazienti risultano ipossici acutamente senza patologie precedenti. In tali pazienti è indispensabile mantenere una saturazione di 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni.. Non portare ad alti valori di Sat O2 i pazienti eviterà l’atelettasia da assorbimento e alterazioni V/Q che possono accadere con alte FI O2.
ATTACCO ASMATICO ACUTO: in analogia con le linee guida SIGN si consiglia di mantenere durante il broncospasmo una saturazione 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni.. Attenzione ai giovani con SatO2< 94% che possono rapidamente deteriorarsi. Una EGA rapidamente eseguita deve escludere alta PaCO2, segno di asma a rischio di vita.
POLMONITE: le linee guida della BTS consigliano una saturazione >92% che vengono fatte proprie da questa linea guida con attenzione ai BPCO.
NEOPLASTICI CON INTERESSAMENTO POLMONARE: in questi pazienti l’ossigenoterapia spesso non risolve la dispnea che migliora con morfina e benzodiazepine. In fase terminale la saturazione non è necessaria.
DISPNEA POST OPERATORIO E IPOSSIA IN AMBITO CHIRURGICO: non ci sono evidenze che supportino l’uso rutinario di ossigeno nel post operatorio . Le linee guida SIGN consigliano di mantenere una saturazione > 92%in tutti i pazienti, con particolare attenzione ai cardiopatici e obesi nella chirurgia toracica e addominale superiore. Nel post operatorio possono comparire ipossia da polmonite acuta, abuso di oppiacei, embolia polmonare; l’ossigenoterapia deve essere applicata in tali condizioni con particolare attenzione per i BPCO.
INSUFFICIENZA CARDIACA ACUTA : in tali pazienti è consigliata una saturazione di 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni.. Si inizia con una FIO2 di 60% per ridurla in base al risultato della terapia medica. Se la sat O2 < 85% è utile la CPAP .
EMBOLIA POLMONARE: spesso tali pazienti non sono ipossici e non necessitano di ossigenoterapia. Occorre mantenere una saturazione 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni.
VERSAMENTO PLEURICO: se un paziente è dispnoico il trattamento risolutivo è il drenaggio, lento per non creare edema polmonare da riespansione parenchimale. Anche le LG della BTS non danno indicazione sull’utilità della ossigenoterapia.
PNEUMOTORACE: come per il versamento pleurico il trattamento è il drenaggio ma se questo non è indicato l’ossigenoterapia con FI O2 100% ( esclusi i BPCO) favorisce il riassorbimento. Nei pazienti drenati l’ossigenoterapia non è consigliata a meno di concomitanti patologie.
PATOLOGIE FIBROTICHE POLMONARI E ALVEOLITI: spesso questi pazienti hanno episodi dispnoici improvvisi, dovuti a banali virosi. Si ha una marcata alterazione del rapporto V/Q che si risolve in acuto con ossigenoterapia a FIO2 60% con sistema Venturi. Si deve mantenere una saturazione 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni. La fibrosi polmonare in pazienti terminali non ha beneficio da una ventilazione invasiva.
DISPNEA NEI PAZIENTI ANEMICI: il sintomo viene risolto con le trasfusioni. Ancora c’è discussioni tra esperti sul livello di Hb sotto al quale si deve trasfondere. Il valore di 7 g% è stato messo in dubbio da uno studio del 1990 che evidenziava un maggior numero di infezioni tra i trasfusi . Ciononostante tale livello viene ancora considerato il target per le trasfusioni. L’ossigenoterapia ha un valore molto ridotto in tali pazienti ma deve essere eseguita in modo da mantenere una saturazione 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni.
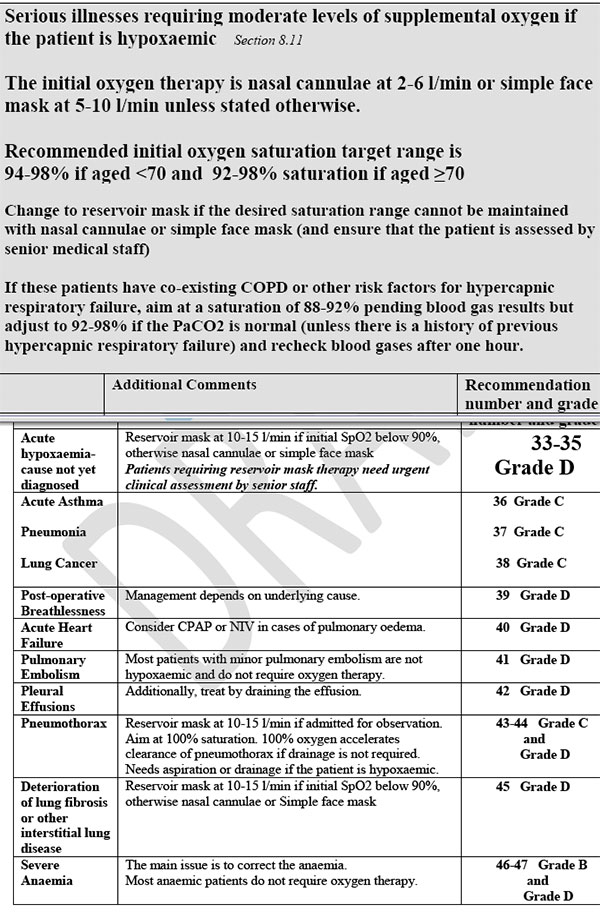
OSSIGENOTERAPIA RACCOMANDATA AI PAZIENTI CHE POSSONO ESSERE VULNERABILI A DOSI MEDIO-ELEVATE DI OSSIGENO
In questo gruppo si dà particolare importanza alla BPCO ma altre patologie sono vulnerabili a dosi medio elevate di ossigeno:
- Severa cifoscoliosi
- Grave obesità ( BMI > 40 )
- Toracoplastiche
- Patologie muscolo-scheletriche con interessamento dei muscoli respiratori
- Overdose di oppiacei, benzodiazepine o altri farmaci depressori dell’attività respiratoria
Tali pazienti possono diventare ipercapnici se la PaO2 > 70 mmHg
BPCO RIACUTIZZATA: ci sono plurimi articoli che testimoniano gli effetti dell’ossigenoterapia in tale patologia. I pazienti con pregressi episodi ipercapnici dovrebbero avere un documento che allerti i sanitari sull’uso di ossigeno supplementare. In assenza di informazioni è ragionevole tenere una Sat O2 dell’ 88-92% in attesa di una rapida EGA. In alcuni casi si può tenere una Sat O2 del 85-90% se il paziente è in acidosi ( ph < 7.5 ) ma è ormai noto che tali pazienti sono ad alto rischio di vita e devono essere trattati con NIV e ossigenoterapia supplementare. Un articolo riporta un maggior rischio di morte, una maggiore degenza ospedaliera e una più alta percentuale di NIV in BPCO con PaO2 > 75 mmHg.
Valgono allora le seguenti raccomandazioni:
- I pazienti > 50 anni, con frequenti episodi di dispnea mai indagata devono essere considerati per questa linea guida BPCO
- Pazienti che giungono in Pronto Soccorso con BPCO riacutizzata o altre patologie potenzialmente ipercapniche devono essere fatte accedere subito negli ambulatori.
- Prima di ottenere una EGA, ai pazienti a rischio di ipercapnia ma senza storia di patologia definita dare ossigenoterapia con Venturi 24 % o ossigeno nasale 2 L per ottenere una saturazione di 88-92%. Se la frequenza respiratoria è > 30 atti / minuto il flusso dovrebbe essere il doppio di quello indicato dall’augello del Venturi.
- Se il paziente ha avuto pregresse acidosi respiratorie cercare di ottenere dalla documentazione un target di saturazione di ossigeno, se non disponibile mantenere una saturazione di 88-92%.
- Se la prima EGA non evidenzia ipercapnia portare la saturazione a 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni, a meno che non ci sia una storia di pregressa ipercapnia.
- A tutti i pazienti a rischio ipercapnico rifare una EGA dopo un’ora anche se l’EGA iniziale era nella norma
- Se la PaCO2 è elevato ma il pH nella norma si tratta di una ipercapnia cronica, rifare l’EGA dopo un’ora.
- Se il paziente ha PaCO2 > 40 mmHg e pH < 7.35 deve essere iniziata la NIV , specialmente se dopo 30 minuti di terapia convenzionale permane acidosi.
- Una volta che il paziente si è stabilizzato si può passare dalla Venturi alla nasale.
FIBROSI CISTICA: valgono le stesse considerazioni fatta per i BPCO.
PATOLOGIE MUSCOLOSCHELETRICHE E NEUROLOGICHE: di solito sono episodi dispnoici subacuti ma in rari casi, come nella Guillian- Barrè, pure acuti. La NIV è più utile dell’ossigenoterapia in questi pazienti. Una EGA deve essere subito ottenuto, nel frattempo mantenere una saturazione di 88-92%.
OBESITA’ CON IPOVENTILAZIONE: si devono usare le stesse precauzione dei pazienti con BPCO, pure in questi la NIV può essere utile.
EMERGENZE MEDICHE IN CUI L’OSSIGENOTERAPIA E’ INDICATA SOLO SE E’ PRESENTE IPOSSIA
Ci sono alcune patologie ( IMA, angina, stroke ) in cui si pensava che somministrare ossigeno potesse migliorare la situazione nelle zone ischemiche. Trial randomizzati hanno invece dimostrato che somministrare ossigeno in pazienti non ipossici non porta beneficio e qualche danno potenziale in quanto l’iperossia riduce il flusso locale. Anche nella dispnea, se non accompagnata da ipossia, l’ossigenazione non porta miglioramenti prognostici.
INSUFFICIENZA CORONARICA ACUTA: non c’è evidenza di un miglioramento della sopravvivenza con ossigenoterapia, anzi alcuni studi hanno mostrato una riduzione del flusso coronarico con iperossia. Si consiglia quindi di mantenere una saturazione a 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni, con particolare attenzione agli scompensati
STROKE: non ci sono evidenze sull’ossigenoterapia nello stroke. Uno studio dimostra un aumento di mortalità nel gruppo sottoposto a ossigenoterapia . Pure qui si consiglia una saturazione a 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni. Sulla posizione in cui tenere i pazienti dispnoici con ictus ischemico o emorragico, uno studio non ha mostrato differenze nella posizione semiseduta o supina. Gli autori consigliano di mantenere, nei BPCO con stroke, la posizione più semiseduta possibile.
GRAVIDANZA: non ci sono evidenze sull’uso dell’ossigeno durante il parto o nel peri-partum , ma occorre mantenere una saturazione di 94-98%. Un uso inappropriato dell’ossigeno causa acidosi fetale. Non ci sono evidenze sull’iperossigenazione della madre con feto ipossico.
ANSIA E IPERVENTILAZIONE: spesso i pazienti manifestano dispnea pur essendo normossiemici, spesso si tratta di crisi ansiose, ma non occorre dimenticare la polmonite, l’ embolia polmonare o l’intossicazione da CO. Studi su volontari hanno mostrato, dopo iperventilazione, una rapida discesa della PaO2 da ipoventilazione di compenso. Queste linee guida non consigliano l’uso di sacchetti chiusi in cui fare respirare i pazienti ansiosi, a meno che non si sia sicuri dell’origine della dispnea e si monitorizzi la saturazione.
INTOSSICAZIONE DA BLEOMICINA E PARAQUAT: vari sono i tossici che possono creare depressione respiratoria con ipossia, ma questi due tossici si potenziano con l’ossigeno per cui non deve essere dato ossigeno; alcuni propongono miscele respiratorie con FIO2 al 14%. Da ricordare che i danni polmonari da bleomicina possono peggiorare con ossigenoterapia anche dopo anni dal trattamento.
PATOLOGIE RENALI, ENDOCRINE, METABOLICHE: questi pazienti sono tachipnoici per compensare una coesistente acidosi metabolica. Non devono assumere ossigeno e mantenere una saturazione a 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni.
L’USO DELL’OSSIGENO IN AMBULANZA E IN AMBIENTE PRE-OSPEDALIERO
Durante il soccorso a domicilio e durante il trasporto verso l’ospedale è fondamentale dare la quantità necessaria di ossigeno. L’ipossia crea danni cardiaci, renali e cerebrali. Ma anche l’iperossia nei BPCO può creare ipercapnia e coma. E’ quindi fondamentale avere chiari i target di saturazione per i vari pazienti. Spesso i pazienti a domicilio hanno documenti che consigliano il valore di saturazione da ottenere.
Appena un sanitario in emergenza visita un paziente dispnoico deve:
- Eseguire un rapido ABC
- Eseguire una rapida anamnesi
- Ottenere una saturazione
- Ottenere altre misurazioni a secondo della patologia ( PEF nell’asmatico acuto, pressione arteriosa nello scompensato )
Se la via aerea è pervia iniziare l’ossigenoterapia usando i target consigliati da questa linea guida.
Per i pazienti con nota BPCO si raccomanda di non superare una PaO2 di 75 mmHg cioè mantenere una saturazione tra 88-92%. Purtroppo spesso la diagnosi di BPCO non è conosciuta; si consiglia di considerare BPCO tutti i pazienti > 50 anni, fumatori o ex fumatori con storia di dispnea da sforzo. Sono da considerare a rischio ipercapnico pure gli scoliotici gravi, gli obesi ( BMI > 40), i pazienti con pregressa TBC sottoposti a toracoplastica, i pazienti con malattia neuromuscolare. Ne pazienti con documentazione di pregressa acidosi respiratoria ipercapnica mantenere una saturazione di 85-90% in attesa di una EGA.
In ambulanza devono essere presenti:
- Una maschera non rebreathing con reservoir per alti flussi di ossigeno
- Una maschera facciale semplice per bassi dosaggi di ossigeno
- Una maschera Venturi 28% da usare nei BPCO a rischio ipercapnico se non è raggiunta la saturazione prevista
- Una maschera per tracheostomizzati
ASPETTI PRATICI DELL’OSSIGENOTERAPIA
L’ossigenoterapia è composta di due componenti:
- il sistema di immagazzinamento cioè le bombole
- un sistema di erogazione come la maschera Venturi
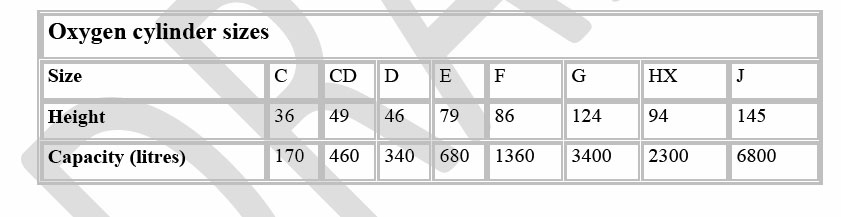
SISTEMA DI IMMAGAZZINAMENTO: sono cilindri di altezza diversa contenente ossigeno ad alta pressione
SISTEMA DI EROGAZIONE :
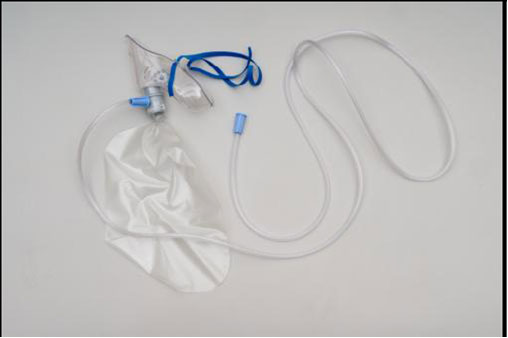
MASCHERE CON RESERVOIR AD ALTA CONCENTRAZIONE: sono usate nelle emergenze e possono erogare ossigeno a una FIO2 tra 60-90 % se si eroga un flusso di 10-15 litri. La concentrazione esatta dipenderà dalla frequenza respiratoria e dal volume corrente.
MASCHERE FACCIALI SEMPLICI: da concentrazioni di O2 tra 40-60%. Tale variabilità dipende dalla frequenza respiratoria, dal volume corrente e dai litri erogati. Si possono erogare tra 5 a 10 litri al minuto , sotto i 5 litri ci possono essere fenomeni di rebreathing e aumento della CO2 inspirata. Per questi motivi non è adatta nel sospetto BPCO o nei pazienti a rischio ipercapnico. Inoltre è mal tollerata dai pazienti che preferiscono la canula nasale.

MASCHERA DI VENTURI: grazie al principio di Venturi tali maschere riescono a mantenere una FIO2 fissa mantenendo il flusso consigliato sugli augelli. Esistono augelli per il 24-28-35-40-60% di FIO2. La Venturi 24-28% è utile nei pazienti a rischio ipercapnico che non raggiungono la saturazione target in attesa dell’ EGA. I pazienti con una frequenza respiratoria > 30 atti/minuto eccedono il flusso erogato dalla maschera per cui è indicato aumentare il flusso indicato sull’augello. La FIO2 indicata non è reale se la maschera non aderisce al viso del paziente.
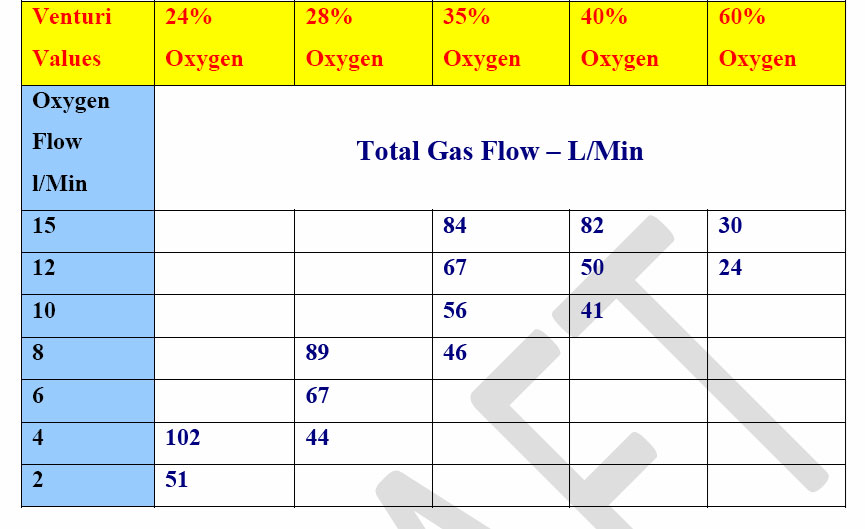
Il miglioramento della saturazione dopo ossigenoterapia a FI costante dipenderà dalla saturazione di base del paziente. Un paziente ipossico sarà nell’area ripida della curva di dissociazione dell’emoglobina per cui la saturazione si alzerà rapidamente, un paziente non ipossico risentirà minimamente della Venturi.
CANULA NASALE: può erogare dosi medio basse di ossigeno. Visto che ogni paziente ha un pattern respiratorio diverso uno stesso flusso di ossigeno porta a FIO2 diverse. Comunque si ritiene che 1-4 L/minuto di O2 abbia gli stessi effetti di una Venturi 24%. Si può aumentare il flusso fino a 6 L/minuto ma i pazienti dopo i 4 L /minuto provano fastidio. Comunque vi è ampia variabilità tra pazienti e il flusso si può regolare in base alla saturazione. Uno studio comparativo tra maschera Venturi e canula nasale in pazienti BPCO riacutizzati mostra che la saturazione risulta < 90% per 5.4 ore al giorno con la maschera venturi e 3.7 ore al giorno con la canula nasale
La maschera facciale e la canula nasale hanno prestazioni simili ma la maschera facciale non può essere usati con flussi < 5 L/minuto. Inoltre la canula nasale permette di parlare e di mangiare. In uno studio su pazienti post chirurgici la canula nasale era la preferita.
MASCHERA TRACHEOSTOMICA: viene usato nei pazienti tracheostomizzati, con particolare attenzione all’umidificazione e alla aspirazione di muco.
FLUSSIMETRO: si tratta di un cilindro con una pallina flottante che segnala il numero di litri di O2 erogati.
TUBI DI COLLEGAMENTO: esistono dei tubi in plastica che collegano il flussometro alle maschere
USO DI OSSIGENO UMIDIFICATO: le normali vie aeree scaldano, filtrano e umidificano l’aria. Quando esiste una patologia grave a danno delle vie aeree superiori o un loro bypass, queste funzioni vengono a cessare ed è pratica comune umidificare i gas erogati. Non esiste però una evidenza di tale metodica in pazienti non intubati, eccetto usare l’aereosol con fisiologica per aumentare l’espettorazione se le secrezioni sono viscose.
USO DI OSSIGENO NEI TRACHEOSTOMIZZATI
Si usa una maschera tracheostomica; fondamentale è umidificare e scaldare la miscela per fluidificare le secrezioni.
USO DI OSSIGENO DURANTE AEREOSOL CON BRONCODILATATORI
Durante un attacco asmatico severo è fondamentale aggiungere ossigeno al broncodilatatore per aereosol per il rischio di ipossia. Se il meccanismo di aereosol non fornisce ossigeno questo va dato con canula nasale 2-6 L/minuto. Alcuni studi hanno però visto un aumento dell’alterazione del rapporto V/Q ( per vasodilatazione da ossigenoterapia ) con successiva ipossia.
Per i pazienti con BPCO a rischio acidosi respiratoria occorre dare ossigeno a 1-4 L/minuto in aggiunta all’aereosol con broncodilatatore per raggiungere una saturazione di 88-92%. Finito l’aerosolterapia riprendere l’ossigenoterapia con Venturi a FI O2 costante.
MONITORAGGIO DELL’ OSSIGENOTERAPIA
Il saturimetro deve essere sempre presente durante ossigenoterapia, ben sapendo che non dà informazioni su PaCO2 e pH. Inoltre la saturazione viene misurata sul flusso arterioso e in caso di mani fredde, ipotensione non riesce a misurare. Appena arrivati in Pronto Soccorso un EGA deve essere eseguito annotando la saturazione di ossigeno erogata. Se il paziente è a rischio ipercapnico l’EGA deve essere ripetuta ogni 30 minuti. Pazienti stabili con saturazione a 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni non necessitano di ulteriori rilevazioni emogasanalitiche.
Altre misurazioni periodiche consigliate sono l’ Early Warning Scoring o similari.
SVEZZAMENTO DALL’OSSIGENOTERAPIA
Nella maggio parte delle patologie acute appena il paziente migliora l’ossigenoterapia viene ridotta e poi sospesa se il paziente riesce a mantenere, senza dispnea , una saturazione a 92-98% per i pazienti di età > 70 anni , 94-98% per i pazienti di età < 70 anni o altra saturazione se questa è quella del paziente stabile. Altri pazienti diventeranno dispnoici durante minimi sforzi e, se ipossici, richiedono ossigenoterapia durante l’attività fisica; se non c’è ipossia non ci sono dati sull’uso dell’ossigenoterapia in tali pazienti. Alcuni pazienti saranno dimessi in ossigenoterapia domiciliare.
COME RIDURRE L’OSSIGENOTERAPIA: deve essere ridotta gradualmente. La dose più bassa è la Venturi 24% e la canula nasale a 1 L /minuto. Se il paziente mantiene in due osservazioni successive il target di saturazione con tali flussi può interrompere l’ossigenoterapia. Si deve monitorare la saturazione nei successivi 5 minuti e verificare che rimanga nel target. Poi dopo un’ora. Se la saturazione è la desiderata l’ossigenoterapia è terminata ma misurazioni periodiche della saturazione devono essere rilevate in relazione alla patologia del paziente.
Se lo svezzamento non funziona ripartire dal flusso di ossigeno più basso e ripetere lo svezzamento più tardi. Se il flusso più basso non basta a raggiungere la giusta saturazione occorre riconsiderare il paziente e le cause del fallito svezzamento. I pazienti dispnoici durante uno sforzo necessitano di ossigenoterapia solo durante lo sforzo.