Il 98% dell’ossigeno (O2) presente nel sangue viene trasportato dall’emoglobina (Hb), la parte restante è disciolta nel sangue secondo la legge di Henry (la quantità disciolta è proporzionale alla pressione parziale dell’O2). Quando la pressione di ossigeno è di circa 95 mmHg (sangue arterioso), in 100 ml di sangue sono disciolti 0,29 ml di Ossigeno. La pressione di O2 è anche in grado di regolare quanto ossigeno si lega all’emoglobina (saturazione dell’emoglobina – SatO2): quando la PO2 è pari a circa 95 mmHg (arterie), la SatO2 è di 97%, mentre quando è pari a 40 mmHg (sangue venoso) la SatO2 scende al 75%.
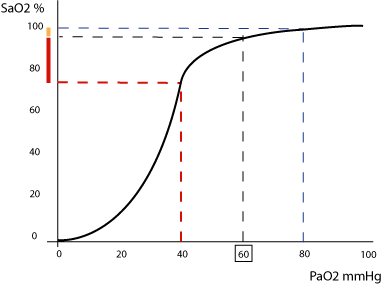
La relazione tra saturazione dell’emoglobina e pressione di ossigeno nel sangue è rappresentata da una curva a “esse italica“, riportata qui sotto:

Si può notare come all’aumentare della PO2 aumenti la saturazione dell’emoglobina, in particolare nella porzione centrale ripida della curva, dove a piccole variazioni in aumento o in diminuzione della pressione di ossigeno corrispondono grandi variazioni della saturazione. Ciò permette di regolare perfettamente gli scambi gassosi: nei tessuti, infatti, dove la pressione di ossigeno è bassa, l’emoglobina può cedere facilmente l’ossigeno. Allo stesso tempo quindi bisogna tener presente che sotto certi valori di SatO2 (80%) la pressione di ossigeno scende rapidamente sotto i 60 mmHg (insufficienza respiratoria acuta).
La forma a esse italica della curva dipende dal fatto che l’emoglobina è un tetramero, ovvero una proteina composta da 4 parti, ognuna delle quali presenta un gruppo Eme in grado di legare una molecola di ossigeno. Ogni volta che si crea un legame con una molecola di ossigeno, aumenta l’affinità per l’ossigeno degli altri gruppi eme e viceversa. La mioglobina, che invece è un monomero, ha una affinità maggiore per l’O2 e quindi lo rilascia solo quando la pressione di ossigeno nei tessuti è molto bassa.
La curva, inoltre, si sposta verso destra (cioè si riduce l’affinità dell’Hb per l’ossigeno e quindi aumenta la capacità di cederlo) se diminuisce il pH,aumenta l’anidride carbonica (CO2), aumenta la temperatura, aumenta la concetrazione di 2,3-difosfoglicerato nei globuli rossi (intermedio del metabolismo glicolitico che si lega all’emoglobina riducendone l’affinità per l’O2): tutto ciò avviene nei tessuti quando consumano ossigeno, favorendo, in tal modo, la cessione di altro ossigeno. Lo spostamento a destra dovuto all’aumento della CO2 (riduzione del pH) prende il nome di effetto Bohr.
Vi ricordo che un grammo di Hb lega circa 1,34-1,39 ml di ossigeno. Tenendo presente che normalmente si trovano 15 grammi di Hb per 100 ml di sangue, nel sangue arterioso possono essere trasportati fino a un massimo di 20 ml di ossigeno per 100 ml di sangue
Ricordate che in caso di intossicazione da monossido di carbonio (CO) la SatO2 può risultare normale: ciò accade perchè i saturimetri rilevano la porzione di emoglobina legata, ma in questo caso…è legata al CO invece che all’ossigeno!