Prolungamento dell’intervallo QT dell’elettrocardiogramma e rischio di aritmie ventricolari associato all’uso di farmaci non antiaritmici
1. Introduzione
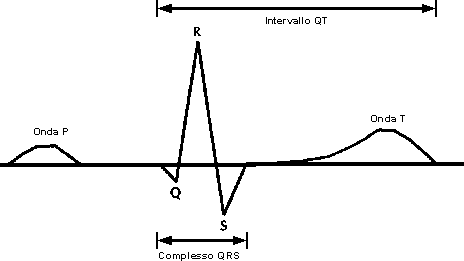
L’intervallo QT dell’elettrocardiogramma è una misura indiretta della durata dei fenomeni di depolarizzazione e ripolarizzazione ventricolare (Figura 1).

L’intervallo QT si misura in unità di tempo (normalmente millisecondi). Dal momento che la sua durata dipende dalla frequenza cardiaca, al fine di confrontare valori ottenuti a diverse frequenze, esso viene di solito “corretto” (QT corretto o QTc) riportandolo a quello che si avrebbe alla frequenza ideale di 60 battiti al minuto con la formula di Bazett:
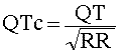
Va tuttavia ricordato che la formula di Bazett non è l’unica utilizzata e che essa ha alcune importanti limitazioni, che non è il caso di approfondire in questa sede.
Tutti i farmaci che ritardano i fenomeni di ripolarizzazione ventricolare, e pertanto aumentano la durata del potenziale d’azione, portano ad un prolungamento del QTc. Molti farmaci antiaritmici (tipicamente gli antiaritmici di classe III, come l’amiodarone ed il sotalolo, ma anche alcuni antiarimici di classe I, come la chinidina), bloccando i canali del potassio deputati alla ripolarizzazione cardiaca, prolungano il potenziale d’azione (pertanto prolungano l’intervallo QT) e, di conseguenza, il periodo refrattario. Se da un lato l’effetto sul periodo refrattario è ritenuto responsabile dell’azione antiaritmica, in quanto contrasta i fenomeni di rientro, dall’altro un aumento del QTc è associato ad un aumento del rischio di insorgenza di un tipo particolare di tachiaritmia ventricolare polimorfa, noto come torsione di punta (TdP). Tale aritmia conduce facilmente alla fibrillazione ventricolare (per maggiori dettagli sugli aspetti fisiopatologici si vedano).
È un’acquisizione relativamente recente che non solo gli antiaritmici possono influire sulla durata del potenziale d’azione, ma anche numerosi farmaci appartenenti a diverse classi terapeutiche comprendono tra i loro effetti collaterali il prolungamento del QTc. Ciò può costituire un grave rischio per il paziente, specialmente nel caso di farmaci assunti al di fuori dell’ambiente ospedaliero. Dal momento che negli ultimi anni si sono intensificate le segnalazioni di allungamento dell’intervallo QT e di TdP a carico delle più diverse classi di farmaci, questa lezione si prefigge lo scopo di presentare una rassegna aggiornata sull’argomento, fornendo alcuni elementi utili all’interpretazione dei dati sulla “cardiotossicità” di farmaci che prolungano il QTc. Innanzitutto va ricordato che il prolungamento del QTc è un marker surrogato di tossicità, usato soprattutto a scopo regolatorio, poiché le osservazioni di TdP sono un fenomeno relativamente raro, difficilmente evidenziabile negli studi pre-registrazione.
Uno dei motivi per i quali il prolungamento del QTc da parte di farmaci che non abbiano indicazioni come antiaritmici è divenuto oggetto di particolare attenzione, sia da parte delle autorità regolatorie sia da parte delle aziende farmaceutiche, è l’apparente assenza di analogie nella struttura chimica tra le molte classi di farmaci che prolungano il QTc. Questa osservazione ha fatto sorgere il quesito se l’effetto sulla ripolarizzazione cardiaca sia comune a tutti i farmaci appartenenti ad una data classe (ad es. antiistaminici, neurolettici, etc.) o non piuttosto un effetto manifestato solo da alcuni composti. In effetti, in molti casi (ad esempio antistaminici) si è dimostrata vera la seconda ipotesi.
I numerosi interventi sia da parte di agenzie regolatorie sia da parte di industrie farmaceutiche (alcuni esempi sono riportati nella Tabella 1) hanno indotto a chiedersi se, in alcuni casi, un programma più attento di indagini pre-marketing avrebbe potuto prevenire alcuni tra gli eventi fatali segnalati. In effetti, risulta assai complesso stabilire un nesso di causalità tra assunzione di un dato farmaco e insorgenza di TdP: si vedano ad esempio i singoli casi clinici descritti da Woosley e Darrow e Shivkumar. Sebbene il prolungamento dell’intervallo QT venga rilevato con frequenza relativamente alta, le aritmie potenzialmente fatali, come le TdP, sono rare e difficilmente compaiono durante gli studi di fase I-III, quando viene esposto al farmaco un limitato numero di soggetti. In ogni caso, va tenuto presente il fatto che almeno alcuni dei casi di aritmia fatale da farmaci riportati in un passato recente avrebbero potuto essere evitati se già allora fossero state note le possibili interazioni farmacocinetiche-farmacodinamiche, ad esempio fra macrolidi e cisapride. Le considerazioni suesposte sottolineano l’importanza di un attento programma di farmacovigilanza durante la fase IV.
2. Classi di farmaci e meccanismi alla base del prolungamento del QT
Anche con una semplice ricerca MEDLINE è possibile individuare numerosi articoli che associano al prolungamento dell’intervallo QT farmaci appartenenti alle classi terapeutiche più varie. Con i termini MESH “long-QT-sindrome-chemically-induced” o “torsades-de-pointes-chemically-induced” nella letteratura pubblicata dal 1985 al 1998, ad esempio, vengono selezionate 391 voci, di cui il 50% riguardanti case report o case series. Esclusi gli antiaritmici, le classi di farmaci con il più alto numero di casi risultano gli antipsicotici, gli antiinstaminici anti-H1 ed i macrolidi. La Tabella 2 presenta un elenco di composti associati a prolungamento dell’intervallo QT o casi di TdP. Una tale varietà di molecole ha indotto i farmacologi ad interrogarsi sul meccanismo molecolare implicato nel prolungamento dell’intervallo QT da parte di molecole apparentemente non correlate tra loro.
La durata dell’intervallo QT è la somma della durata dei fenomeni di depolarizzazione e ripolarizzazione ventricolare e si ritiene rifletta la durata del potenziale d’azione dei cardiomiociti, controllata a sua volta da un delicato bilancio elettrolitico tra correnti dirette verso l’interno e verso l’esterno nella fase di ripolarizzazione. In questa fase, un ruolo importante viene svolto dalle correnti del potassio “outward” IK (somma di due correnti distinte sia per l’aspetto cinetico che per quello farmacologico: una rapida IKr e una lenta IKs) e piccole variazioni della conduttanza possono modificare significativamente la durata del potenziale d’azione ed il periodo refrattario.
Diversi studi confermano la teoria secondo cui, per la maggior parte dei farmaci, il meccanismo alla base del prolungamento del QT è correlato al blocco dei canali del potassio. Farmaci quali amiodarone e d-sotalolo esercitano il loro effetto antiaritmico di classe III attraverso questo meccanismo: il d-sotalolo, in particolare, blocca completamente la componente rapida della IK (IKr) a concentrazioni che non hanno effetti sulla IKs. Anche farmaci non antiaritmici, associati ad un prolungamento dell’intervallo QT di rilevanza clinica (come terfenadina, astemizolo e macrolidi), si sono dimostrati in grado di inibire la componente rapida della corrente (IKr), bloccando i canali del potassio codificati dallo human ether-à-go-go-related gene (HERG).
Pur essendo la corrente IK (nelle sue componenti IKr e IKs) quella meglio studiata, non si può escludere che il prolungamento della durata del potenziale d’azione dipenda anche da altre correnti del potassio (es. le correnti Ito, IKur e IK1). Il contributo di una data corrente nell’ambito dei processi di ripolarizzazione può dipendere dal tipo di canali ionici espressi in zone diverse del cuore (es. atrio o ventricolo), dalle specie e dalle condizioni fisiopatologiche (frequenza cardiaca ridotta o elevata; miocardio ischemico o normale). Il ruolo delle diverse correnti nel potenziale d’azione cardiaco in condizioni fisiologiche o patologiche è tuttora oggetto di studio e le conoscenze sinora acquisite in questo campo sono per ora estrapolabili solo in parte al contesto clinico.
3. Rilevanza clinica
Poiché l’aumento del QTc rappresenta solo un marker surrogato di tossicità ed il rischio di insorgenza di aritmie sembra direttamente correlato al QTc, sarebbe utile poter stabilire valori soglia (Delta-QTc) per definire la rilevanza clinica del fenomeno. Sul significato dell’aumento del QTc, recentemente l’EMEA ha suggerito quanto segue:
- aumenti del QTc (corretto utilizzando la formula di Bazett) inferiori a 30 ms sono considerati in genere scarsamente significativi ai fini del rischio di aritmie;
- aumenti compresi tra 30 e 60 ms rappresentano un segnale più consistente di un effetto del farmaco e pongono interrogativi sul reale rischio di aritmie;
- aumenti superiori a 60 ms sollevano serie preoccupazioni sul rischio di TdP.
Tuttavia è importante ricordare che, non esistendo un valore di Delta-QTc che possa fare da riferimento assoluto quanto a rischio di TdP, è essenziale identificare tutti gli altri fattori di rischio che, specialmente se associati all’uso di farmaci, possono provocare la comparsa di TdP (Tabella 3).
È opportuno insistere sul fatto che la corretta prescrizione dei farmaci che hanno la potenzialità di aumentare il QTc richiede la conoscenza approfondita non solo dei fattori di rischio indicati in tabella 3, ma anche la disponibilità di elenchi aggiornati di farmaci che hanno effetto sul QT.
La disponibilità di elenchi aggiornati di tali farmaci potrebbe risultare particolarmente utile ai soggetti affetti dalla sindrome del QT lungo congenita ed ai loro famigliari che, pur avendo un valore di QTc nei limiti della norma, sono portatori della mutazione genetica e pertanto devono accuratamente evitare qualunque fattore che possa agire sulla ripolarizzazione cardiaca. In alcuni casi, mediante studi elettrofisiologici in vitro, si è riusciti a dimostrare che i canali del potassio “mutati” sono più sensibili di quelli “wild-type” a farmaci largamente utilizzati come la claritromicina e il sulfametossazolo.
Essendo le torsioni di punta da farmaci eventi complessivamente rari, è opportuno focalizzare l’attenzione sui farmaci prescritti più comunemente. Un’indagine di farmacoutilizzazione relativa al 1998 rivela che la popolazione italiana è esposta, in ambito extraospedaliero, ad un totale di 12 DDD/1000 abitanti/die (equivalenti a circa il 2% di tutte le prescrizioni) di farmaci non antiaritmici, per i quali dalla letteratura si ha evidenza di effetti significativi sulla ripolarizzazione cardiaca. Attraverso indagini come questa, sarebbe utile poter individuare i singoli principi attivi associati ad un’esposizione elevata nelle diverse aree geografiche ed incentrare su di essi, almeno inizialmente, gli studi farmaco-epidemiologici.
4. Prospettive future
Per i farmaci già in commercio e con potenziale effetto sull’intervallo QT, sembra opportuno suggerire studi epidemiologici che valutino il rischio dei soggetti esposti ed identifichino possibili fattori di rischio aggiuntivi, come patologie e terapie concomitanti. Nel caso vengano identificati nuovi fattori di rischio sarà necessario apportare le relative modifiche alle schede tecniche, e programmare interventi (analoghi ad una “Dear Doctor letter”) per favorire la divulgazione dell’informazione. Anche interventi regolatori per l’armonizzazione delle informazioni presenti nelle schede tecniche sarebbero particolarmente utili. Infatti, attualmente, a parità di evidenze sul rischio proaritmico, in alcuni casi (soprattutto per farmaci già in commercio da molto tempo) si cita semplicemente il rischio di “aritmia cardiaca” nella sezione delle reazioni avverse, mentre, nel caso di farmaci più recenti, vengono talvolta incluse avvertenze sul rischio di prolungamento del QT e di torsioni di punta anche solo per analogia con i congeneri.
Nel caso, invece, un farmaco non antiaritmico risulti avere effetti sul QTc prima della registrazione, per il momento non è possibile formulare precise linee guida sulle indagini da effettuare, anche se numerose pubblicazioni affrontano l’argomento in modo molto dettagliato. Il documento dell’EMEA rappresenta un utile punto di partenza. In questo documento, vengono brevemente discussi i problemi riscontrati nel definire le alterazioni della ripolarizzazione indotte dai farmaci negli studi preclinici e clinici. La tabella 4 affronta sinteticamente i numerosi quesiti che si devono affrontare per misurare ed analizzare correttamente l’intervallo QT. Ad esempio, per la valutazione dei potenziali rischi clinici associati alle alterazioni del QTc, si dovrebbero prendere in considerazione alterazioni individuali piuttosto che valori medi per la popolazione in studio. Inoltre, studi che riportino un’assenza di effetti sul QTc devono essere valutati criticamente, considerando la potenza statistica dello studio. Infatti, una differenza statisticamente non significativa tra il gruppo trattato e il controllo non dimostra necessariamente che il composto non ha effetto sul QTc. Al contrario, quando, all’interno di un processo di valutazione regolatorio, un farmaco non antiaritmico mostra un’evidente azione sul QTc, è necessario giudicare la rilevanza clinica del fenomeno attraverso diversi parametri (relazione dose-risposta, indicazione terapeutica proposta, probabilità di interazioni farmacocinetiche, etc.). Secondo la nostra opinione, registrare un nuovo farmaco non antiaritmico che abbia effetti sul QTc è giustificabile solo quando ciò comporta un’innovazione significativa rispetto alle terapie esistenti.
Concludendo, per i farmaci sperimentali, che devono ancora ricevere l’approvazione formale da parte delle autorità regolatorie, sono auspicabili:
- la standardizzazione delle procedure negli studi preclinici in vitro e in vivo (specialmente riguardo alla misurazione del QTc), per compiere uno screening delle diverse molecole;
- studi di fase I-III accuratamente disegnati, che tengano conto dei fattori elencati nella tabella 4, specialmente per quei farmaci che sembrano avere un pur limitato effetto sulla ripolarizzazione cardiaca negli studi preclinici.
Se quanto detto sopra è valido al giorno d’oggi, non è escluso che in un prossimo futuro gli sforzi congiunti del farmacologo molecolare e del chimico farmaceutico portino ad identificare esattamente il farmacoforo/ i farmacofori responsabili di un’azione su specifici canali ionici deputati alla ripolarizzazione cardiaca. In tal caso, gli studi in silico (svolti cioè mediante modellistica molecolare computerizzata) potranno forse permettere di prevedere se una molecola abbia potenziali effetti sulla ripolarizzazione cardiaca già durante lo sviluppo preclinico, prima ancora degli studi in vitro e in vivo.
5. Tabelle
| Tabella 1. Esempi di interventi su farmaci che prolungano l’intervallo QT | ||
| USA | Europa | |
| terodilina | ritiro a seguito di segnalazioni di torsioni di punta (1991) | |
| terfenadina | – proposta di ritiro (gennaio 1997) aggiunte di avvertenze in scheda tecnica (settembre 1997) – ritiro dopo l’autorizzazione al commercio della fexofenadina (dicembre 1997) |
– ritiro della confezione da 120 mg dal mercato europeo (novembre 1997) – mantenimento in commercio delle confezioni da 60 mg e 30 mg in compresse e della sospensione orale da 6mg/ml (febbraio 1998) |
| sertindolo | raccomandato per l’inserimento in commercio (1996), mai autorizzato | ritirato precauzionalmente dal mercato europeo, in attesa di un giudizio da parte della EMEA (1998) |
| astemizolo | ritirato dalla Ditta produttrice (1999) | ritirato dalla Ditta produttrice (1999) |
| grepafloxacina | ritirato dalla Ditta produttrice (1999) | ritirato dalla Ditta produttrice (1999) |
| cisapride | aggiunte di avvertenze in scheda tecnica (1998) ritirato (2000) |
aggiunte di avvertenze in scheda tecnica (1998)ritirato in alcuni paesi, disponibile solo per indicazioni ristrette in altri (2000) |
| Tabella 2. Esempi di farmaci non antiaritmici associati a segnalazioni di allungamento del QT o insorgenza di TdP | |
| ANTIPSICOTICI | MACROLIDI |
| aloperidolo clorpromazina droperidolo pimozide quetiapina sertindolo tioridazina |
claritromicina eritromicina spiramicina |
| ANTIDEPRESSIVI | ANTIMALARICI |
| amitriptilina desipramina doxepin |
alofantrinachinina |
| ANTIISTAMINICI | CHINOLONI |
| astemizolo difenidramina terfenadina |
grepafloxacina levofloxacina sparfloxacina |
| CARDIOVASCOLARI * | VARI |
| bepridil isoprenalina ketanserina mibefradil |
cisapride ketoconazolo pentamidina probucolo tacrolimus (FK506) terodilina trimetoprim-sulfametossazolo |
L’elenco di farmaci riportato in tabella non è esaustivo ed il rischio di TdP è molto variabile a seconda dei composti, anche se non sono disponibili dati precisi sull’incidenza di TdP. Pertanto il lettore è invitato ad approfondire l’argomento consultando la bibliografia citata a fianco di ciascun composto, facendo anche riferimento a recenti rassegne.
| Tabella 3. Fattori di rischio per l’insorgenza di torsioni di punta | |
|
Legati al paziente
Legati al farmaco
|
| Tabella 4. Problematiche relative alla misurazione ed all’analisi dell’intervallo QT a seguito della somministrazione di farmaci | |
|
Variabilità legate al paziente
Misura dell’intervallo QT
Farmacocinetica
Analisi e interpretazione dei dati
|
| Fonte: http://www.farmacovigilanza.org/ – Elisabetta Poluzzi – Fabrizio De Ponti – Nicola Montanaro |
| Le foto presenti sul sito sono state in larga parte reperite su Internet e quindi valutate di pubblico dominio. Se i soggetti o gli autori avessero qualcosa in contrario alla pubblicazione, non avranno che da segnalarlo all’indirizzo e-mail admin@soccorritori.ch, lo Staff provvederà prontamente alla rimozione delle immagini utilizzate. |



